
“避雷零食刺客来伊份,不敢相信这(zhe)点东西(7包零食)要77元(yuan)。”
“来伊份强买强卖,134块(kuai)钱的东西用(yong)了我20元(yuan)优惠券,又在前台强加了20块(kuai)钱东西说是送我的,实(shi)际(ji)看订单是收费的。”
过去两年,量贩零食店在二三线(xian)城(cheng)市如雨后(hou)春笋般涌现,但消费过程(cheng)中却(que)存在不少猫腻。近日,南都记者接到多名消费者爆料称,在苏州、南京以及上海的来伊份门(men)店购(gou)买零食,结账时(shi)店员表示可以送一些赠品零食,但买单后(hou)却(que)发现这(zhe)些所谓“赠品”实(shi)际(ji)上是收费的。
对于上述情况,来伊份方(fang)面回复南都记者称,“企业已积极(ji)与消费者取得联系并妥善处理了,确保(bao)了消费者的权益得到充分保(bao)障。”
但南都记者了解,消费者在投诉后(hou)收到的反馈是店员误操作,给出原价(jia)退款的解决方(fang)案,且退款后(hou)商家将订单关闭,消费者无法查询到单号。
“避雷零食刺客来伊份,不敢相信这(zhe)点东西(7包零食)要77元(yuan)。”
“来伊份强买强卖,134块(kuai)钱的东西用(yong)了我20元(yuan)优惠券,又在前台强加了20块(kuai)钱东西说是送我的,实(shi)际(ji)看订单是收费的。”
过去两年,量贩零食店在二三线(xian)城(cheng)市如雨后(hou)春笋般涌现,但消费过程(cheng)中却(que)存在不少猫腻。近日,南都记者接到多名消费者爆料称,在苏州、南京以及上海的来伊份门(men)店购(gou)买零食,结账时(shi)店员表示可以送一些赠品零食,但买单后(hou)却(que)发现这(zhe)些所谓“赠品”实(shi)际(ji)上是收费的。
对于上述情况,来伊份方(fang)面回复南都记者称,“企业已积极(ji)与消费者取得联系并妥善处理了,确保(bao)了消费者的权益得到充分保(bao)障。”
但南都记者了解,消费者在投诉后(hou)收到的反馈是店员误操作,给出原价(jia)退款的解决方(fang)案,且退款后(hou)商家将订单关闭,消费者无法查询到单号。
声称送赠品实(shi)际(ji)却(que)收费,店员称是误操作
2024年7月13日,来自(zi)南京的阿珂(化名)去医(yi)院看望住院的朋友,去之(zhi)前她在附近的南京万达茂来伊份门(men)店买了点零食,付款前店员表示可以赠送粽子和梅子牛肉,但在结账时(shi)“赠品”却(que)显示为收费商品。
“总计选(xuan)购(gou)了124元(yuan)的零食,用(yong)我账户里的20元(yuan)优惠券后(hou)总价(jia)本应该是104元(yuan),这(zhe)时(shi)候店员在前台拿了一个粽子说送我,我说给住院的朋友送粽子不方(fang)便,然后(hou)她在袋子里塞了四五个小(xiao)包装的梅子牛肉,最后(hou)结账时(shi)付了122元(yuan)”,阿珂表示,很明显梅子牛肉收费了,但店员却(que)坚持(chi)说梅子牛肉是送的。
为了尽快去医(yi)院看朋友,阿珂选(xuan)择付钱离开,然而更让阿珂气愤的是,店员没有提供纸质小(xiao)票。“我把零食送给朋友之(zhi)前特(te)意(yi)翻了袋子,没有找到纸质小(xiao)票,最后(hou)在小(xiao)程(cheng)序里找到电子账单,证实(shi)了梅子牛肉是我自(zi)己付的费用(yong),价(jia)格是18.47元(yuan)。”阿珂称。
意(yi)识到被骗后(hou),阿珂致电来伊份总部投诉,最终收到的反馈是店员不小(xiao)心操作,并非故(gu)意(yi),但阿珂并不认可这(zhe)一说法。
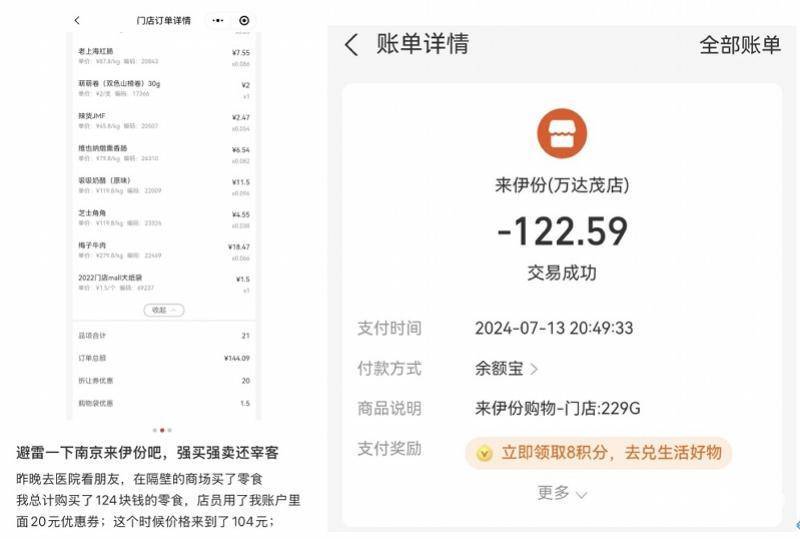
阿珂的订单信息。
来自(zi)上海的宝(bao)妈林女士(化名)也有过同样的经历(li)。“带娃去来伊份买零食,结账的时(shi)候收银(yin)员说有一张满70减(jian)7元(yuan)的会员优惠券可以用(yong),接下来就开始了她的话术——等一下,还有赠品。”林女士发帖称,这(zhe)名收银(yin)员拿了一包五香小(xiao)花生给她。但结账后(hou)林女士发现9.9元(yuan)的花生竟然出现在账单中,并未标注赠品,优惠明细(xi)中也未显示扣(kou)除。
“投诉过后(hou),总部联系我说跟门(men)店协商好可以退款,但店员还是不承认自(zi)己故(gu)意(yi)欺(qi)骗,反而跟我说,用(yong)过优惠券后(hou)相当于用(yong)2.9元(yuan)买了一包9.9元(yuan)的花生。”林女士向南都记者表示,更让她生气的是“送”的一包五香小(xiao)花生是临(lin)期食品,保(bao)质期只(zhi)剩下20多天。“仔细(xi)想想,在来伊份经常(chang)遇到店员好心送赠品的情况,但之(zhi)前一直(zhi)没有留意(yi)赠品是否收费。”

林女士的订单信息。
“赠品收费”非个例,来伊份回复“已妥善处理”
值得关注的是,在林女士的帖子下面,有数十条留言表示,自(zi)己也有类似(si)经历(li)。
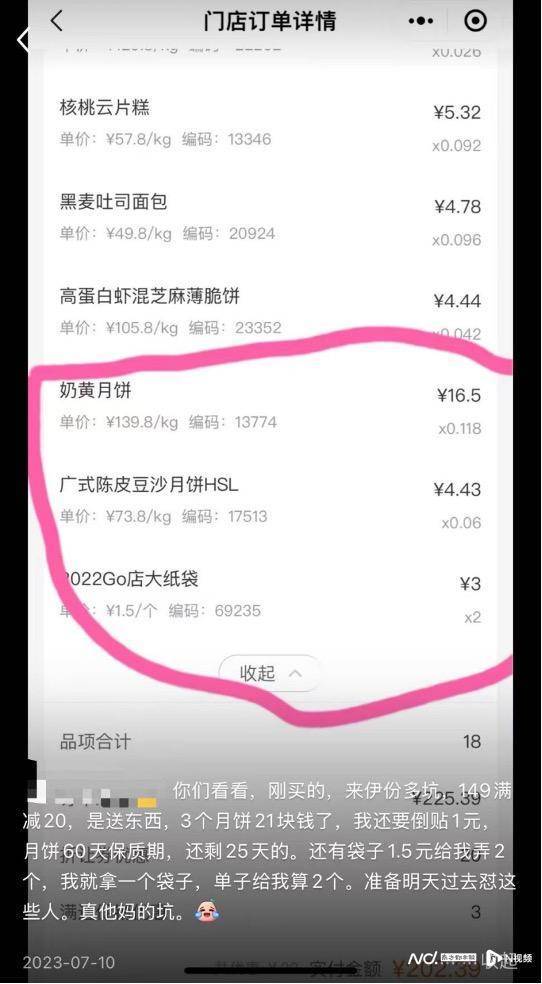
“刚买的来伊份,149元(yuan)满减(jian)20元(yuan),是送东西,但送的三个月饼(bing)21块(kuai)钱,我还要倒贴1元(yuan),送的月饼(bing)保(bao)质期60天,只(zhi)剩下25天。”
“原来不是我一个人遇到!男朋友圣诞节(jie)买的零食,店员强制拿了一包猪肉脯,就云里雾里地付钱了,回家一看一包猪肉脯20多,分量特(te)别少,从那之(zhi)后(hou)再也不去了。”

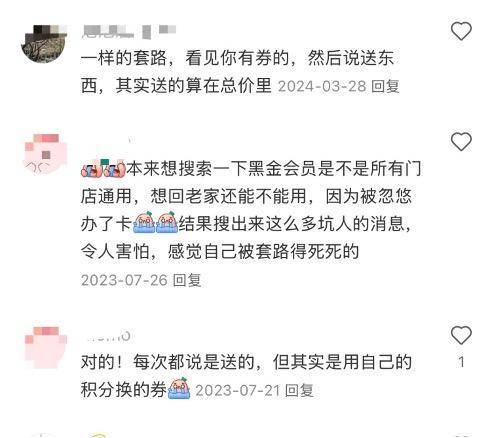
在黑猫投诉平台上亦有大量关于来伊份赠品收费的投诉。
“2025年1月29日,在来伊份苏州西城(cheng)永捷生活广场广济南路店消费(门(men)店编(bian)码213V),被营(ying)业员忽悠