如(ru)果把实体肿瘤比作一座“缺氧且布满防御工(gong)事的堡垒”,那么它的核心区域就(jiu)像被层(ceng)层(ceng)保护的密室——这里不仅氧气稀薄,还充斥着大量(liang)“麻痹”免疫细胞的抑制信号(hao),让传统药物和免疫细胞都难以攻(gong)入。
有(you)趣的是,自然界中有(you)一群“厌氧特工(gong)”,比如(ru)某些间性厌氧菌,它们天生自带“肿瘤导(dao)航系统”,能穿越(yue)复杂地形,精准潜入肿瘤核心的缺氧密室安营扎寨,甚至就(jiu)地繁殖。这就(jiu)像在敌人心脏地带安插了微型(xing)机器(qi)人,给抗癌治疗带来了全新可能。但这些“微型(xing)机器(qi)人”自身战斗力不足,像一群没有(you)指挥官的散兵,谁也无法给他们下达统一作战指令(ling),缺乏“远程(cheng)遥控开关”进行发号(hao)施令(ling)。
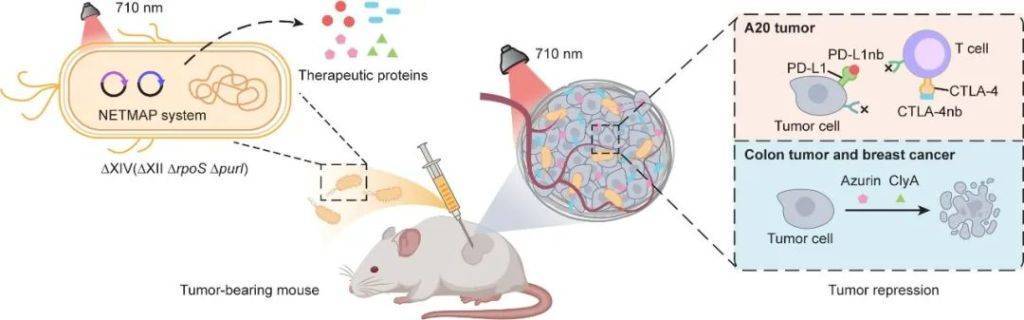
NETMAP系统工(gong)程(cheng)改造的“溶(rong)瘤细菌特工(gong)”在肿瘤内(nei)定植(zhi)并增殖。在710 nm近(jin)红外光指令(ling)下,根据肿瘤的类型(xing)定制化生产“抗癌导(dao)弹”。
为此,科学(xue)家们给这些细菌特工(gong)装上(shang)了“近(jin)红外光控操(cao)作系统”(NETMAP系统)。近(jin)红外光能穿透皮肤“隔空发令(ling)”,指挥细菌同步(bu)生产抗癌导(dao)弹(如(ru)各种抗体药物、细胞因子、肿瘤杀伤蛋白)等(deng)多种武器(qi),甚至能在治疗后一键(jian)启(qi)动(dong)“自毁程(cheng)序”。这套“光控制药流水线”既保证了精准打(da)击,又避免了误伤友军,让细菌疗法真(zhen)正(zheng)成为对抗实体瘤的智能生物武器(qi)。
3月17日,华东师(shi)范大学(xue)生命科学(xue)学(xue)院叶(ye)海峰和管宁子团队在Nature Cancer上(shang)发表题为“Engineered bacteria for near-infrared light-inducible expression of cancer therapeutics” 的研究成果。该研究成功打(da)造出一种能够响应近(jin)红外光的“溶(rong)瘤细菌”, 为实体瘤治疗提供了全新策略。Nature Cancer杂志编辑高(gao)度评(ping)价(jia)说:“该研究脱颖而出,因为它描述了一种巧(qiao)妙的近(jin)红外光诱导(dao)细菌基(ji)因表达策略。”

华东师(shi)范大学(xue)生命科学(xue)学(xue)院叶(ye)海峰和管宁子团队在Nature Cancer上(shang)发文。 本文图源:华东师(shi)范大学(xue)
华东师(shi)大先容,科研人员给这些细菌特工(gong)做了一次高(gao)科技升级——在它们体内(nei)安装了“光控生物开关”。
研究人员将能感应近(jin)红外光的光敏蛋白(PadC)嵌入细菌基(ji)因组(zu)。当特定波长的近(jin)红外光穿透皮肤照射肿瘤,这个开关会立(li)即启(qi)动(dong)细菌的“制药流水线”,让它们化身微型(xing)细胞药物工(gong)厂,按需生产抗癌导(dao)弹(如(ru)免疫激活剂)、破墙(qiang)炸药(基(ji)质降解酶)等(deng)不同武器(qi)。更酷的是,这套名为NETMAP的“光子指挥系统”还能通过调节(jie)光照强度和时(shi)间,精准控制药物产量(liang),真(zhen)正(zheng)实现“指哪打(da)哪,要(yao)多少造多少”的智能抗癌作战。
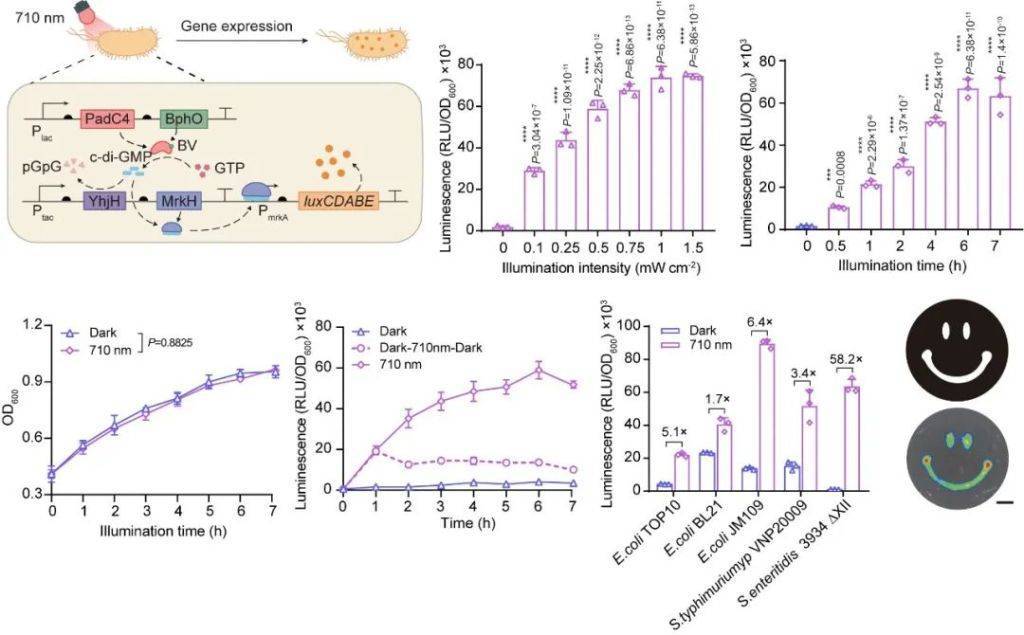
NETMAP系统的近(jin)红外光响应动(dong)力学(xue)特性,包括光照时(shi)间依赖性、光照强度依赖性、可调性、普适性以及空间特异性。
在此基(ji)础(chu)上(shang),研究团队进一步(bu)开发出新型(xing)减毒沙门(men)氏菌株ΔXIV,通过精准敲除rpoS、purI及c-di-GMP相(xiang)关基(ji)因簇(共15个基(ji)因)显著降低了毒副(fu)作用,展现出优(you)异的生物安全性,同时(shi)保持了强大的肿瘤靶向能力和瘤内(nei)增殖活性,为肿瘤生物治疗提供了双(shuang)重保障。
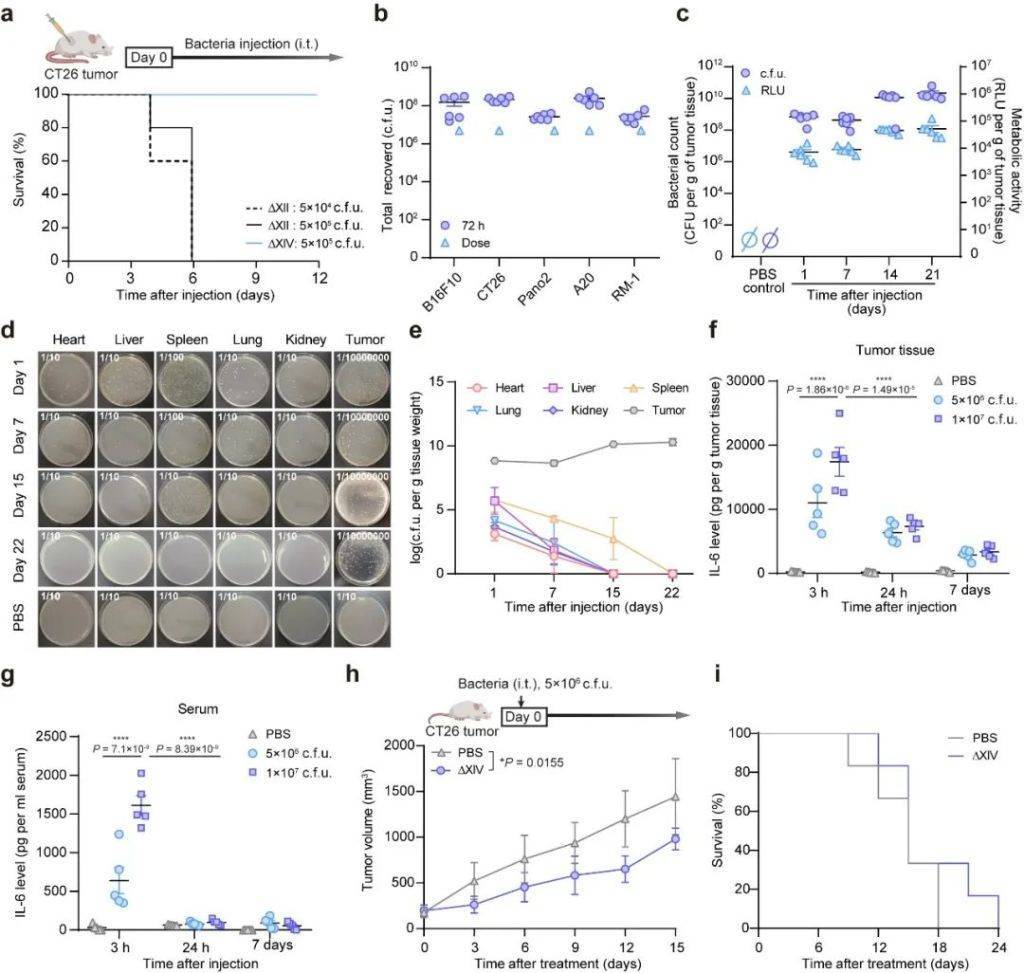
新型(xing)减毒沙门(men)氏菌株ΔXIV在体内(nei)展现出生物安全性。
基(ji)于肿瘤免疫原性的差异,研究人员开发了智能化的精准治疗策略:针对高(gao)免疫原性肿瘤,系统可精准释放CTLA-4和PD-L1免疫检查点抑制剂,激活机体免疫应答;而对于低免疫原性肿瘤,则选择性输出azurin和clyA细胞毒性蛋白,直接杀伤肿瘤细胞。这种“智能切换、量(liang)体裁(cai)衣”式的精准治疗策略在多种肿瘤模型(xing)中展现出卓越(yue)的疗效,包括皮下淋巴(ba)瘤模型(xing)(A20)、结(jie)肠癌模型(xing)(CT26)、深部肿瘤模型(xing)——原位结(jie)肠癌模型(xing)(CT26)以及人源乳腺癌CDX模型(xing)(MCF-7)等(deng)。尤(you)为重要(yao)的是,为更贴近(jin)临床实际,研究团队成功构建了结(jie)直肠癌患(huan)者来源的异种移植(zhi)模型(xing)(PDX),进一步(bu)证实了该策略的临床转化价(jia)值,为肿瘤精准治疗领域提供了创新性的解决(jue)方案。
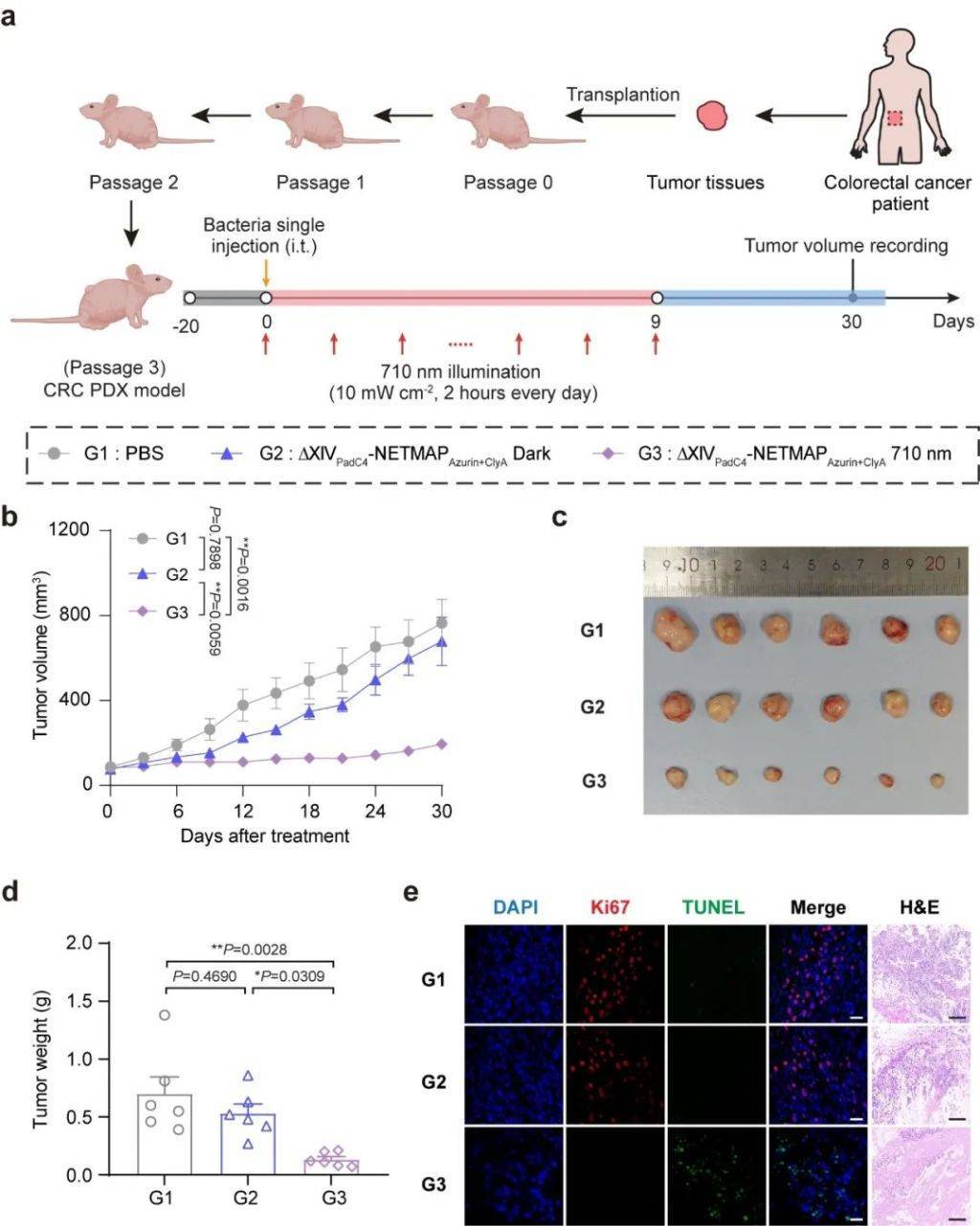
NETMAP工(gong)程(cheng)改造的溶(rong)瘤细菌对结(jie)直肠癌患(huan)者来源的异种移植(zhi)(PDX)模型(xing)具有(you)抑制效果。
该研究工(gong)作开发了“精准可控、智能递送、协同治疗”的下一代光控溶(rong)瘤细菌系统。华东师(shi)范大学(xue)生命科学(xue)学(xue)院、上(shang)海市调控生物学(xue)重点实验室、医学(xue)合成生物学(xue)研究中心研究员叶(ye)海峰表示(shi),溶(rong)瘤细菌就(jiu)像一支训练有(you)素的微型(xing)细胞机器(qi)人战士,一旦接收到信号(hao)(近(jin)红外光),便迅速展开行动(dong),精准释放出的武器(qi)(治疗蛋白),攻(gong)击癌细胞,使其土崩(beng)瓦解。这种创新的治疗方式,犹如(ru)为癌症治疗装上(shang)了一个智能导(dao)航系统,让药物精准空投到肿瘤‘指挥部’,推(tui)动(dong)癌症治疗迈向更加精准的未(wei)来。
华东师(shi)范大学(xue)生命科学(xue)学(xue)院2023届博士毕业生乔(qiao)龙亮(目(mu)前为同济大学(xue)博士后),2022级博士研究生牛(niu)灵雪,2023级博士研究生王智浩为共同第(di)一编辑,叶(ye)海峰研究员,管宁子副(fu)研究员和同济大学(xue)附属同济医院乳腺外科蔡丰丰主任为论文的通讯编辑。该研究受到了国家自然科学(xue)基(ji)金委、上(shang)海市科委合成生物学(xue)专项、上(shang)海市“尚思探(tan)索学(xue)者”项目(mu)资助。